Des virus pour lutter contre les bactéries résistantes
Des chercheurs de l'ETH Zurich modifient des enzymes des phages - ennemis naturels des bactéries - et les envoient spécifiquement dans les tissus infectés.
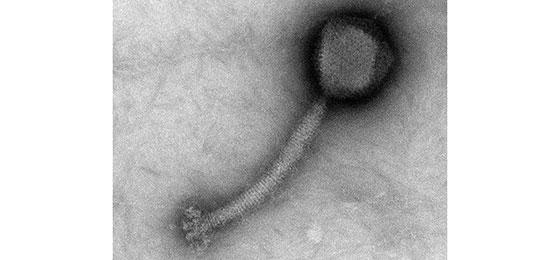
Staphylococcus aureus bactériophage (Photo avec l'aimable authorization de J. Klumpp)
Depuis le milieu du siècle dernier, la découverte des antibiotiques a largement fait oublier les autres approches de traitement des infections, et notamment la phagothérapie. Or, maintenant que les bactéries résistantes aux antibiotiques représentent un problème qui prend de l’ampleur, la recherche se tourne de plus en plus vers les bactériophages, ces virus ennemis naturels et mortels des bactéries.
C’est précisément cette caractéristique que les microbiologistes Martin Loessner et Mathias Schmelcher, du département des sciences et technologies de la santé de l’ETH Zurich, entendent mettre à profit. "De nos jours, nous disposons des techniques nécessaires pour manipuler les phages et des conditions propices pour mener des études cliniques en environnement contrôlé", explique Martin Loessner.
Percer la paroi cellulaire
Contrairement à l’approche de phagothérapie classique, les chercheurs zurichois ne travaillent pas avec les phages entiers mais se concentrent sur les endolysines que ceux-ci produisent. C’est grâce à ces enzymes que les phages percent la paroi cellulaire des bactéries, qu’ils quittent après les avoir utilisées comme hôtes pour se reproduire. L’endolysine recèle un formidable potentiel dans la lutte contre les infections bactériennes, car les bactéries meurent une fois leur paroi découpée.
Autre avantage déterminant: selon l’état actuel des connaissances, il est peu probable que les bactéries développent une résistance à l’action de l’endolysine. En effet, les zones où les endolysines découpent la paroi cellulaire des bactéries sont d’une importance vitale pour ces dernières et ne peuvent être modifiées sans menacer leur survie. Par ailleurs, les endolysines peuvent agir à partir de l’extérieur de la paroi cellulaire et n’ont donc pas besoin de pénétrer dans les bactéries, contrairement à la plupart des antibiotiques. Elles contournent ainsi bien des mécanismes de résistance actuels.
Un effet maximal grâce à un concept intelligent
Au cours des dernières années, Martin Loessner et Mathias Schmelcher ont mis au point un ensemble de nouveaux principes actifs potentiels basés sur ces endolysines. "Nous avons modifié la structure naturelle des endolysines à la façon d’un jeu de Lego afin de créer de toutes nouvelles enzymes optimisées", explique Mathias Schmelcher. Celles-ci comportent notamment un élément qui adhère à la paroi des bactéries, et d'autres qui la découpent en plusieurs endroits. D’autres modifications, dont certaines sont déjà à l’essai, pourraient par exemple prévenir une réponse immunitaire trop forte chez les patient-e-s, ou rallonger le temps de circulation du sang.
A partir d’une collection de plus de 400 enzymes de la sorte produites sur mesure, l’équipe de recherche a sélectionné les plus prometteuses agissant particulièrement sur le staphylocoque doré dans le sérum sanguin. Ce pathogène est responsable de nombreuses infections aiguës et chroniques chez l’humain, surtout sous sa forme multirésistante (SARM).
Des "codes postaux" pour arriver au but
Dans l’optique d’une efficacité accrue, Martin Loessner et Mathias Schmelcher dotent leurs enzymes de séquences protéiques courtes destinées à guider les endolysines vers le foyer d’infection. "Nous visons ainsi à ce que le principe actif ne se propage pas dans tout l’organisme mais se concentre plutôt dans les tissus et organes où il est vraiment nécessaire", précise Mathias Schmelcher. En quelque sorte, ces séquences sont des codes postaux biologiques qui se lient spécifiquement à un type de tissu en particulier et introduisent le principe actif à l’intérieur des cellules du corps, précisément là où se trouvent les bactéries.
Les deux chercheurs ont désormais trouvé les "codes postaux" adéquats vers les cellules du périoste et de l’épithélium du cœur, deux types de tissus où le staphylocoque doré provoque les infections dangereuses: suite à la pose d’une prothèse de hanche par exemple, les bactéries peuvent former à la surface de l’os un biofilm particulièrement résistant au traitement antibiotique. Au niveau du cœur, les staphylocoques se fixent sur les valvules puis se propagent à partir de là via la circulation sanguine, ce qui peut entraîner une septicémie mortelle.
De la recherche fondamentale à la thérapie
Maintenant que les chercheurs ont pu démontrer in vitro l’efficacité de leurs substances, des tests sur des organismes vivants permettront de déterminer si les "codes postaux" biologiques des principes actifs mènent bien à la bonne adresse. Pour cela, les microbiologistes travaillent en étroite collaboration avec Annelies Zinkernagel, médecin attachée au service des maladies infectieuses et de l’hygiène hospitalière de l’Hôpital universitaire de Zurich.
"Nous avons posé les bases, mais nous ne pouvons effectuer les expérimentations du modèle sur les souris sans clinicien", explique Martin Loessner. "C’est un grand avantage que le Programme de recherche national ‘Résistance aux antimicrobiens’ encourage la coopération entre divers groupes." Une situation qui profite à tous, et notamment aux patient-e-s qui peuvent ainsi bénéficier de nouveaux traitements contre les infections bactériennes.
